再生医学への貢献
慢性的臓器機能欠損疾患の治療として,臓器移植が注目されており,我が国においても最近,脳死に関する法律が施行され,移植治療の挑戦が高まっている.しかし,この治療法においては,ドナーによる臓器供給律速となっており,ドナーに頼らない治療法“再生医学による組織や臓器の機能再生”を目指した流れが将来の主流になると考えられている.
この方法は,成熟個体において増殖能を保持している幹細胞(Stem cells)を患者本人またはドナーから取り出し,in vitroで増殖させる.その後,組織や臓器へと分化させ,最終的には患者へ移植・再構築させる治療法である.これまで,種々の組織や臓器において検討が重ねられてきたが,対象としては,火傷や慢性皮膚炎の患部に対して皮膚の再生治療,スポーツ選手などの関節損傷に対する軟骨の再生治療等があげられる.
特に皮膚の再生治療には,1975年に初めてGreenら により,患者本人のケラチノサイト(Keratinocyte)を培養・分化させ得られた培養皮膚(Skin graft)を患部に移植してから,米国や欧州を中心に活発に臨床がなされてきた.
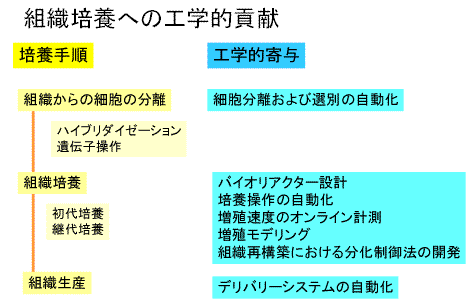
これまで接着因子,分化・再生のメカニズムなどの生化学,発生医学的な質的改善に対する研究は数多くなされてきたが,培養皮膚の生産方法などの培養工学的見地からの培養方法,培養制御法等の研究がほとんど行われていない.
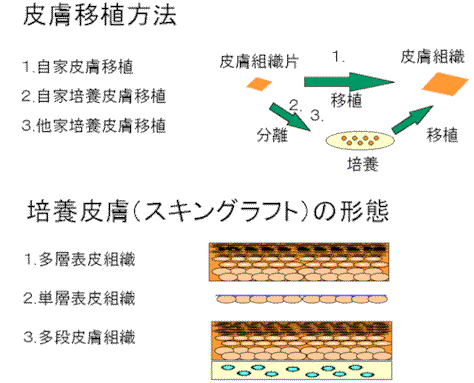
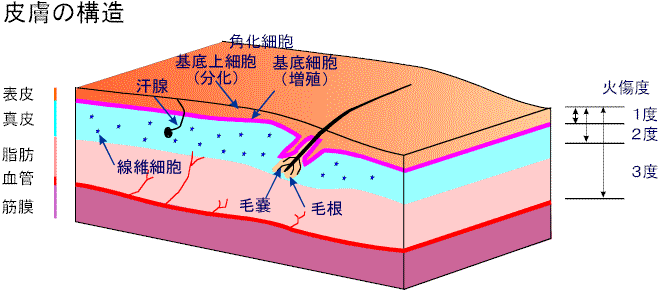
皮膚移植の主な手順としては,患者の皮膚の上皮からケラチノサイトを分離し,初代培養を行い,数代の継代培養後細胞数を増やし,皮膚分化を誘導し,ケラチノサイトの多重層からなる培養皮膚を生産する. この培養皮膚を,患部に移植し皮膚組織の再構築を行わせる.ケラチノサイトの培養は,単純な静置培養で,接種,培地交換,回収等の作業からなる.
生産サイズは,患部の大きさにより異なるが,火傷患者の対象の場合は,体全体の50%から80%のサイズ,つまり数千cm2のケラチノサイトの培養行う必要がある.現在のところ,小スケール(数十〜数百cm2)ですべて熟練技師の手作業で行っている.
そのため,培養皮膚の総生産コストのうち,人件費は高い比率を占めており,医療費の高騰を招いている.一方,医学と工学の連携は世界でも例が少ないためか,動物実験や臨床結果に対する医学的評価に,培養特性などの結果から得られる培養工学的評価を導入した例はほとんど無く,患者やドナー個々によって異なるケラチノサイトの増殖速度と回復能との相関などの評価を行い再生治療の改善を行うことが重要となる.